Cristales de chocolate

Por Nahuel Vega. Dr. en física.
O por qué la barrita derretida que estaba en tu bolsillo, cuando se enfrió, no quedó igual. ¿Alguna vez se preguntaron por qué el chocolate es tan extraño cuando se derrite? Seguramente, alguna vez derritieron y moldearon una vela, que también es una sustancia con alto contenido de grasa, y obtuvieron una vela nueva con las mismas características que la original.
Pero con el chocolate eso no es tan fácil. Si dejamos una barra en el bolsillo se derrite, pero después no queda igual, sino más pastosa y más blanda, aunque esté mucho tiempo a temperatura ambiente. La razón por la que ocurre esto no es sencilla e involucra a una región difusa entre la química y la física llamada cristalografía.
En la escuela nos enseñan que la materia puede estar en tres estados: sólido, líquido y gaseoso. Los últimos dos forman parte de lo que llamamos fluidos. Son estados donde hay poca atracción entre las moléculas, por eso fluyen. En estado sólido, las moléculas se atraen mucho entre ellas y por eso los sólidos son difíciles de romper. Muchas veces, las moléculas en los sólidos se acomodan de una forma muy ordenada, formando cristales. El hielo, el azúcar y la sal son sólidos cristalinos. La forma que tienen externamente los copos de nieve o los granos de azúcar nos pueden dar información sobre cómo se acomodaron las moléculas de esa sustancia.
Pero volvamos al chocolate, las moléculas de la manteca de cacao que forman el chocolate presentan algo que se llama polimorfismo. Pueden acomodarse de distintas formas generando distintos cristales. Imaginemos que las moléculas son ladrillos de plástico como los de la imagen (1). Los ladrillos tienen partes que encastran, formando un enlace fuerte, y otras que no. En las moléculas es más complejo, pero se aplica la misma idea. Ambas formas de acomodar los ladrillos son posibles, pero encastrarlos genera una estructura más estable.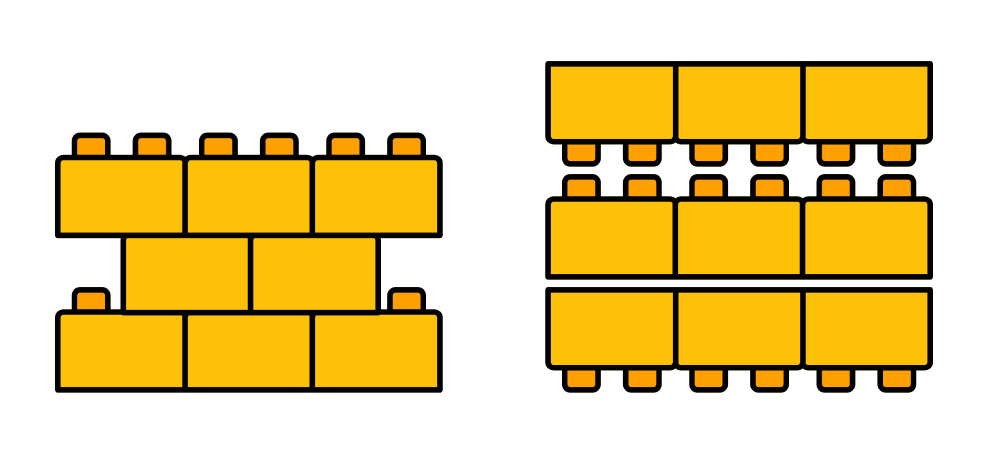
(1) Las moléculas de la manteca de cacao se acomodan como ladrillos de plástico,
pueden hacerlo formando estructuras más o menos estables.
¿Qué implica que podamos formar cristales más o menos estables de chocolate? Los cristales menos estables requieren menos energía térmica para romperse. Cuando la barra de chocolate sale de la fábrica, las moléculas se organizan en una forma cristalina muy estable que funde a 34°C, no se derrite en las manos, pero sí en la boca y hace clack cuando la partimos. Si dejamos una barra al sol o la llevamos mucho tiempo en el bolsillo, alteramos esa estructura cristalina y por eso obtenemos una diferente, medio pastosa y que se derrite en los dedos.
De todas maneras, es posible recuperar la forma cristalina que nos gusta después de derretir una barra mediante un proceso llamado templado de chocolate. El método más sencillo se llama sembrado y requiere derretir parte del chocolate, luego incorporar pedacitos de chocolate sólido templado (como viene de la fábrica) y mezclar muy bien. Al solidificar, las moléculas del chocolate derretido van a acomodarse siguiendo la estructura de las “semillas” de chocolate templado (dato de color: el silicio que forma los circuitos del aparato que estás usando en este momento también es un cristal generado a partir de sembrado). Otro método muy usual es el templado en mármol que implica enfriar el chocolate derretido bruscamente sobre una mesada de mármol o granito generando cristales de las distintas estructuras. Luego, se vuelve a calentar (o remontar) a una temperatura intermedia, fundiendo solo los cristales menos estables que son los que tienen una temperatura de fusión menor a la temperatura de remonte.
Hasta acá les conté una historia que podríamos decir que está “edulcorada”. En realidad, hay dos fases muy estables llamada ß1 y ß2 que funden cerca de los 34° pero las fases menos estables son 4 (ß'1, ß'2 α y y). Todas estas funden a menor temperatura, de hasta 18°.
Sabemos estas cosas porque se pueden hacer experimentos para revelar la estructura interna de los sólidos. De la misma forma que el reverso de un CD separa los colores de la luz visible y vemos una especie de arcoíris, se puede iluminar un chocolate con neutrones o rayos X y estudiar cómo dispersa esa radiación. Así obtenemos una especie de huella digital de cada estructura.
Para terminar, les voy a proponer un experimento. En ciertos casos podemos aprovecharnos de las fases más inestables del chocolate para fabricar lo que yo llamo nido de fideos de chocolate. Se necesita un pedazo de mármol, vidrio, azulejo o alguna pieza de metal gruesa. Hay que llevarla al freezer durante al menos una hora. Después, hay que derretir el chocolate y ponerlo en una manga con un pequeño corte en la punta, de forma que salgan hilos finos de chocolate derretido. Con todo eso listo tenemos que sacar la superficie fría del freezer y rápidamente trazar hilos finos de chocolate derretido. Sin dejar pasar mucho tiempo los podemos despegar y formar el nido porque como este chocolate no está templado, es flexible.

Imagen: Gentileza de Nahuel Vega
Podemos repetir el mismo experimento con baño de repostería (ese que se usa para los huevos de pascua que no necesita templado) y los hilos se van a quebrar. Estos baños suelen ser más económicos que el chocolate. Usan aceites vegetales en lugar de manteca de cacao y siempre cristalizan en una estructura estable y brillante. La lección de este experimento es el mantra de todos los chocolateros: si no requiere templado, no es chocolate.
*Nahuel Vega es doctor en ciencia y tecnología mención física por la Universidad Nacional de San Martín. Realizó sus estudios de posgrado en temas de daño por radiación en semiconductores. Actualmente, se desempeña como profesor de la Universidad Nacional de Hurlingham y trabaja en el área de física de neutrones.
Imagen de portada: Freepik

Tal vez también te interese

