Enzimas: una pequeña molécula, un gran cambio para el alimento

Por Dra. Mara Galmarini - Investigadora Adjunta CONICET. Docente UCA (Twitter: @MVGalmarini)
En el mes de junio festejamos el día de la biotecnología. Por lo general, cuando la pensamos en relación a los alimentos, vienen a nuestra mente nuevos cultivos o microorganismos que pueden realizar de manera más eficiente procesos biológicos como la fermentación. Pero rara vez nos enfocamos en una enorme batería de herramientas que pueden producirse de manera segura a nivel industrial gracias a la biotecnología: las enzimas. En esta nota te contamos de qué se tratan estas proteínas tan especiales, con un rol fundamental en la formulación de alimentos.
Siempre enzimas (sí, con z)
Por su composición, las enzimas son proteínas. Pero son proteínas que tienen una función bioquímica específica: acelerar o facilitar reacciones químicas. En nuestro cuerpo tenemos miles de enzimas diferentes que nos ayudan desde la digestión de los alimentos hasta en la coagulación de la sangre, evitando que un raspón se transforme en una desgracia más grande.
Las reacciones químicas en las que participan las enzimas son diversas. Pueden unir, cortar o modificar de manera puntual las moléculas con las que interactúan. Lo interesante es que son altamente específicas. Ninguna enzima se mete donde no la llaman. Cumplen con su función de forma precisa, casi sin margen de error.
Los humanos no somos los únicos que contamos con estas aliadas. Todos los seres vivos, incluidos hongos y bacterias, fabrican sus propias enzimas. La diferencia es que nosotros aprendimos a entender sus funciones (la de las propias y las ajenas) y logramos aislarlas y producirlas para darles otra utilidad.
Es innumerable la cantidad de enzimas que, gracias a años de investigación, hoy son producidas de manera industrial, principalmente por hongos y bacterias, y su uso es clave en la industria de los alimentos. En esta nota te contamos varios ejemplos.
¡Ah! Pero antes un pequeño aviso que puede facilitar la lectura. Van a encontrar que los nombres de todas las enzimas mencionadas tendrán algo en común, porque se las identifica con la función que cumplen y la terminación “-asa”. Esto es así desde el primer descubrimiento realizado por Anselme Payen (1795-1871) y Jean-François Persoz (1805-1868). Estos químicos franceses aislaron (de la malta) un fermento capaz de romper la molécula del almidón, y decidieron llamarlo en francés diastase, a partir del griego diástasis, que significa ‘separación’. Más tarde comprobaron que la diastasa también estaba presente en la saliva humana. Desde entonces se usa esa terminación para todas las enzimas.
Un jugo natural sin nada de amargo, por favor
Cuando tenemos tiempo de un rico desayuno, es probable que el menú incluya un jugo de naranja o pomelo exprimido. Fácil de adquirir y rico en vitaminas, suele ser una sabrosa opción. Pero hay quienes le agregan un poquito de azúcar porque, así como viene, les resulta amargo.
Este amargor se debe a diferentes compuestos que están presentes en la pulpa, y más aún en las semillas, en la parte blanca (el albedo) o la cáscara rica en aceites esenciales. Se trata de compuestos de la familia de los flavonoides. Algunos de los más amargos son la naringina y la limonina. Su concentración (y por ende la intensidad de amargo) varía con el nivel de maduración, las condiciones de desarrollo y, obviamente, el tipo de fruta.
Resulta que hay un complejo enzimático (eso quiere decir que se necesitan dos enzimas trabajando juntas) que, con un recorte por acá y un cambio por allá, transforman la naringina en naringenina (en la Figura 1 están las fórmulas, ideal para jugar al juego de las diferencias). Un pequeño cambio en el nombre pero una gran transformación para nuestras papilas, porque la naringenina no tiene gusto alguno.
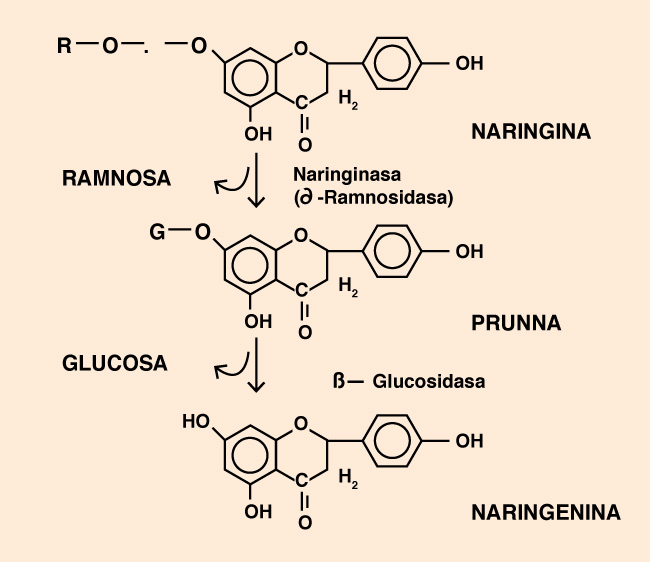
Figura 1. La transformación enzimática de naringina en naringenina. El “desamargado” del jugo de naranja.
Hay métodos físicos que pueden eliminar este compuesto amargo. El problema es que, en el proceso, también se van vitaminas y antioxidantes. En cambio, en la alternativa biotecnológica con naringinasa la actuación es específica sobre el principio amargo, por lo que la composición y la calidad nutricional del jugo final no se ve alterada.
Este proceso de eliminación específica de compuestos amargos se llama “desamargado” (debittering en inglés). Y no, todavía no hay enzimas que puedan hacer esto con las personalidades o actitudes de quienes nos rodean.
Doradito, pero solo del bueno
Pollo asado, papas fritas, milanesas, galletitas, pan. Estos alimentos (y muchos más) tienen en común un color dorado que viene acompañado de sabores y aromas bastante apetitosos: son el resultado de la reacción de Maillard.
Ese es el nombre que se le da a la reacción química entre proteínas e hidratos de carbono a muy alta temperatura y que resulta en una mezcla de muchos compuestos diferentes responsables de esas características sensoriales que a veces nos llevan a raspar la asadera con deseo cuando no nos ven.
Pero no todo es para chuparse los dedos. Entre esos compuestos tan deseados, hay uno que puede ser dañino: la acrilamida. Esta se forma cuando uno aminoácido particular, la asparagina, se descompone.
Para que no toda la reacción de Maillard tenga que pagar por un solo compuesto, la industria de alimentos utiliza en muchos casos la asparaginasa (enzima obtenida en forma industrial a partir de hongos) capaz de modificar la fórmula de este aminoácido en compuestos seguros, antes de que se transforme en acrilamida.
Dulce, pero sin las calorías
Así como rechazamos lo amargo, no hay caso con lo dulce: nos gusta, y mucho. Al menos por ahora, hasta que a fuerza de hábito sostenido nos acostumbremos a cosas menos dulces, y por ende menos calóricas. Pero, mientras tanto, buscamos opciones para reducir la ingesta de carbohidratos simples sin perder gusto.
Los que ayudan en eso son los edulcorantes intensivos, que tienen un alto poder endulzante y se usan en bajas concentraciones. Tal es el caso de la estevia, que además tiene buena fama por ser extraída de plantas. Se la considera un endulzante intensivo natural.
Pero tal como la encontramos en las hojas de la Stevia rebaudiana Bertoni, tiene un regusto amargo que puede resultar bastante desagradable. Esto se debe a que no es una molécula sola (como la sacarosa) sino que hay un grupo de moléculas responsables del gusto, los llamamos esteviósidos y muchos responden a una familia que se llaman alcaloides y son amargos.
Gracias al uso de enzimas, se puede modificar ligeramente la estructura de esteviósidos específicos sin alterar el gusto dulce y eliminando, al menos parcialmente, el regusto amargo. Pero se necesita de varias enzimas diferentes (algunas son: α-amilasa, dextranasa, isomaltasa) para poder mejorar su perfil de sabor. Por eso puede variar mucho el gusto de la estevia según la marca o la aplicación en la que se utilice.
Es bueno recordar que el concepto de natural puede ser engañoso. Porque si bien la biotecnología hace lo suyo entendiendo, por ejemplo, las diferentes funciones y síntesis de las enzimas, todos los compuestos mencionados en esta nota se encuentran en la naturaleza. Al igual que todas las enzimas que los modifican. Solo que a veces necesitan una manito para encontrarse y así mejorar ciertas características que hacen a los alimentos más sanos y sabrosos.
Imagen de portada: freepik.es


